三年半累亏超5亿元!尚无产品上市的恒润达生能成为“科创板CAR-T第一股”吗?
导读:CAR-T细胞治疗时代正在加速到来。近日,上海恒润达生生物科技股份有限公司(下称“恒润达生”)在科创板的上市申请正式获得受理。
记者赵奕 胡金华 上海报道
CAR-T细胞治疗时代正在加速到来。近日,上海恒润达生生物科技股份有限公司(下称“恒润达生”)在科创板的上市申请正式获得受理。
作为一家专注于突破性免疫细胞治疗产品研发与生产的创新生物医药公司,恒润达生主要聚焦恶性血液病和实体肿瘤等治疗领域。根据招股书,该公司本次募集资金约为25.39亿元,其中,13.37亿用于肿瘤免疫细胞治疗产品研发项目,6亿用于总部及产业化基地(一期)项目,6亿元用于补充流动资金。
就本次IPO相关问题,《华夏时报》记者致电恒润达生上海总部,其证券部工作人员表示,目前公司正处于上市前的静默期,一切以官方信息为准。
三年半亏损超5亿元
记者了解到,因为公司处于新药研发阶段,尚无产品上市销售,因此恒润达生至今并无主营业务收入。其2019年的录有19.47万元的其他收入,来自于公司向苏州克睿基因生物科技有限公司提供的一批次实验用逆转录病毒。
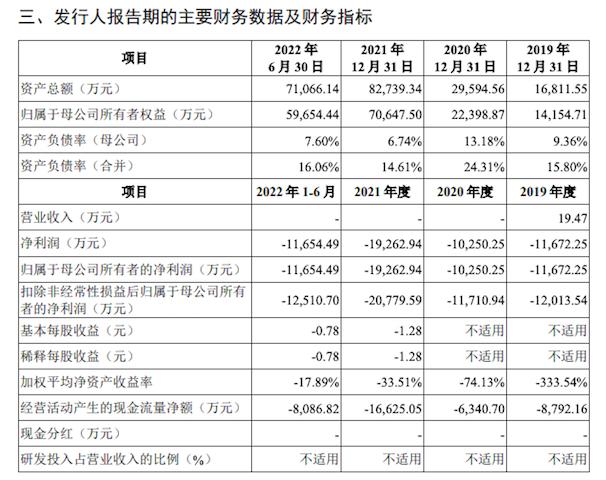
根据招股说明书,2019年至2022年上半年,恒润达生归属于股东的净亏损分别为1.17亿元、1.03亿元、1.93亿元和1.17亿元,三年半合计亏损达5.28亿元。截至2022年6月30日,该公司累计未分配利润为-2.76亿元。
恒润达生在招股书中坦言,公司未来几年将存在持续大规模的研发投入,在可预见的未来经营亏损将不断增加,上市后未盈利状态预计持续存在且累计未弥补亏损可能继续扩大。
而在研发方面,虽然恒润达生的研发投入逐年增加,但与同行业可比上市公司相比,该公司研发投入仍处于较低水平。2019年至2022年上半年,恒润达生的研发费用分别为8436.79万元、8459.53万元、1.6亿元和9964.31万元。公开资料显示,2021年,君实生物、传奇生物的研发费用分别为20.69亿元和19.98亿元,分别是恒润达生的12.9倍和12.5倍。
除研发投入外,恒润达生在报告期内的每一年都进行了股权激励。2019年至2022年上半年,恒润达生的股权激励费用分别为1316.07万元、694.4万元、1786.17万元和661.43万元。
在产品方面,根据招股书,目前恒润达生已建立了包含11个在研项目的产品管线,涵盖CAR-T、CAR-NK和DASH CAR-T。其中,治疗“复发/难治性B细胞非霍奇金淋巴瘤(r/rB-NHL)”的HR001药物研发已进入II期临床注册环节,该产品预计将于2023年递交新药上市申请。若恒润达生及其旗下药物双双成功上市,其将成为首家持有CAR-T上市药物的科创板公司。
公开资料显示,未来CAR-T细胞治疗非霍奇金淋巴瘤的中国市场规模有望快速增长,预计2021年至2025年复合增长率为149.6%,预计2025年至2030年复合年增长率为41%,并在2030年增长至184亿元。
值得注意的是,目前国内已有针对r/r B-NHL的同类药物获批上市销售。恒润达生坦言,其产品未来获批上市销售后,不仅面临与上述品种的直接竞争,还将与同适应症的其他药物展开竞争。若公司重要在研药品临床进展和审批进度不及预期,或公司无法建立有效的商业化销售团队或委托专业的商业化团队进行销售,产品的销售收入可能无法达到预期,从而对公司的业务、财务状况、经营业绩及前景产生不利影响。
国内CAR-T产品崛起加速
记者了解到,以CAR-T为代表的肿瘤免疫细胞治疗是国际前沿的肿瘤治疗方向,目前被认为是最有希望治愈癌症的治疗方法之一,尤其是对末线复发、难治性的肿瘤患者在其他疗法无效的情况下仍显示卓越的疗效。
灼识咨询数据显示,截至2022年4月,全球共有2756项免疫细胞治疗正处于不同研发阶段(含非注册临床试验),较之2021年同期增长约36%。另据,智慧芽《医药生物产业系列——CAR-T细胞免疫治疗市场和创新技术研究报告》显示,全球在CAR-T细胞免疫疗法领域的专利申请目前约有2.1万件。其中,美国在CAR-T细胞疗法领域处于技术领先地位,中国则以明显领先于欧洲和日本的优势紧跟美国。
深圳中金华创基金董事长龚涛向《华夏时报》记者表示,当前中国CAR-T企业大概有一百多家,但从临床在研方向来看绝大多数都集中在CD19、CD20、CD22、GPC3、BCMA等热门靶点上,高水平重复研发现象严重,企业竞争为同质化竞争,大大限制了国内CAR-T企业与国外企业的竞争能力。国内CAR-T企业要多做一些竞争性和开创性研究。
近期,国内CAR-T细胞治疗领域不断传出好消息。10月18日,科济药业-B(2171.HK)公告称,中国国家药品监督管理局(NMPA)已受理其CAR-T细胞候选产品泽沃基奥仑赛注射液的新药上市申请,拟用于治疗复发/难治多发性骨髓瘤。
10月14日,中国国家药监局药品审评中心(CDE)官网公示显示,复星凯特的CAR-T细胞治疗药物阿基仑赛注射液(商品名:奕凯达)第二项适应症申请拟被纳入优先审评,拟开发用于成人大B细胞淋巴瘤患者的二线治疗。
但需要注意的是,已获批上市的CAR-T细胞治疗产品价格均较为昂贵。例如,药明巨诺研发的倍诺达定价高达120万元。
对此,龚涛表示,CAR-T产品与其他新药一样,研发费用高昂,CAR-T企业的投资者在商业利益驱动下快速收回研发成本的唯一捷径就是提高产品价格。
“要压抑投资者快速回笼研发成本的想法基本不可能,就目前来看可以采取的方式有两点:一是加快CAR-T企业上市步伐,让企业创投更多的在股市上获利,转移快速回笼创投资金的途径;二是要从根本上解决此问题,就必须让更多的企业参与到药物研发竞争的队伍中来,同类药物的竞争将大大降低药品的价格水平,扩大行业规模和竞争是目前国家引导的主要方向,也是根本上能解决CAR-T产品价格高昂的唯一途径。”龚涛如是说。
海南博鳌医疗科技有限公司总经理邓之东也向《华夏时报》记者表示,目前市面上的免疫细胞产品大都是患者自体细胞在体外扩增后回输,生产制备周期较长、价格相对昂贵、应用范围有局限,因而限制了细胞免疫疗法更广泛的即时应用。而全球正在马不停蹄研究开发新一代通用、现货型、可量产的细胞治疗产品,在未来有潜力满足临床规模化使用和患者治疗急需即用的需求,发展前景广阔。