只看突变不限癌种,广谱肿瘤药课代表为什么卖不动?
导读:在肿瘤药物领域,广谱抗癌药无疑是价值最大的。
文|氨基观察
在肿瘤药物领域,广谱抗癌药无疑是价值最大的。
PD-1便是典型。PD-1数百亿美金市场规模的基础,便是基于广泛的适用人群。不过,这也是默沙东等药企们一步一个脚印,投入无数资金和时间开拓众多适应症,才得到的回报。
相比之下,NTRK靶向药物的征程要轻松不少。7月29日,NTRK靶向药物恩曲替尼在国内获批上市,适应症为:
“适用于经充分验证的检测方法诊断为携带NTRK融合基因且不包括已知获得性耐药突变,患有局部晚期、转移性疾病或手术切除可能导致严重并发症,以及无满意替代治疗或既往治疗失败的成人和12岁及以上儿童实体瘤患者。”
也就是说,恩曲替尼一次性就解锁了所有NTRK基因突变的肿瘤群体。对此,市场也将之称为“不限癌种”的神药。
不过,这款热度较高的广谱肿瘤药课代表,上市后销售额却不尽如人意。这又是为什么呢?
01 靶点式获批,多个癌种均可用
精准治疗时代,肿瘤药物申请上市主要是基于极为细分的适应症,分类依据包括癌种、患者分期等。
核心原因在于,不同病灶、不同阶段等因素都会导致肿瘤微环境有所差异。而这些差异,会使得一款治疗药物,针对同靶点突变A类型的患者有效,而对B类型的患者失效。
而恩曲替尼的焦点在于“靶点式获批”,即一次获批,所有NTRK突变患者都适用,不管是肺癌还是结直肠癌,或者是乳腺癌。
这也可以理解,谁让恩曲替尼仅通过一次临床,就证明自己具备泛癌种打击能力。
根据其三项临床结果,恩曲替尼对肉瘤、非小细胞肺癌、涎腺分泌性癌、乳腺癌、神经内分泌癌的客观缓解率分别高达59.4%、64.5%、84.6%、66.7%、和40%。
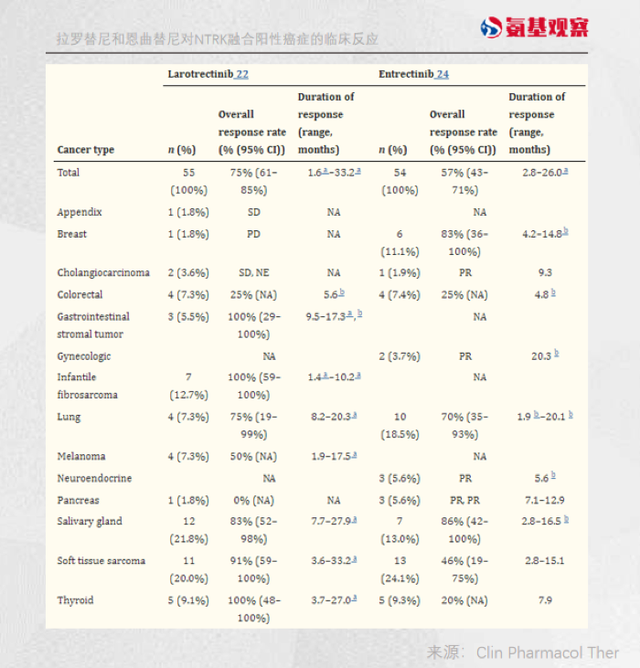
并且,由于恩曲替尼具有较强的穿透血脑屏障能力,可以在中枢神经系统中大剂量暴露。对于一些免疫疗法无能为力的脑转移患者也有较好效果。
根据恩曲替尼三项临床整合数据,针对NTRK融合基因阳性实体瘤成人患者,无论基线脑转移状态,客观缓解率达到61.3%,中位缓解持续时间高达20.0个月。
又能对于广谱抗癌,既能够穿越血脑屏障,这使得恩曲替尼被不少人视为“万能药”。
国内药企的研发热情也较为高昂。国内贝达药业、诺诚健华、正大天晴、轩竹药业等药企,都在研发针对NKRT的泛癌种抗癌药。
02 “万能药”不万能,商业化前景有限
不过,从商业角度出发,恩曲替尼并没有像外号“万能药”那样充满想象空间。
根据上文提及的适应症,我们简单提炼一下恩曲替尼适用患者需要满足这两点要求:
一是要携带TRK融合基因且不具备获得性耐药;
二是没有其他治疗方案可选的晚期患者。
其中,仅携带TRK融合基因这一条,就使得不少患者被拒之门外。
据临床数据显示,像非小细胞肺癌、结直肠癌、浸润性乳腺癌这些患者群体较大的癌种,发生携带NTRK基因融合变异的患者不到1%。
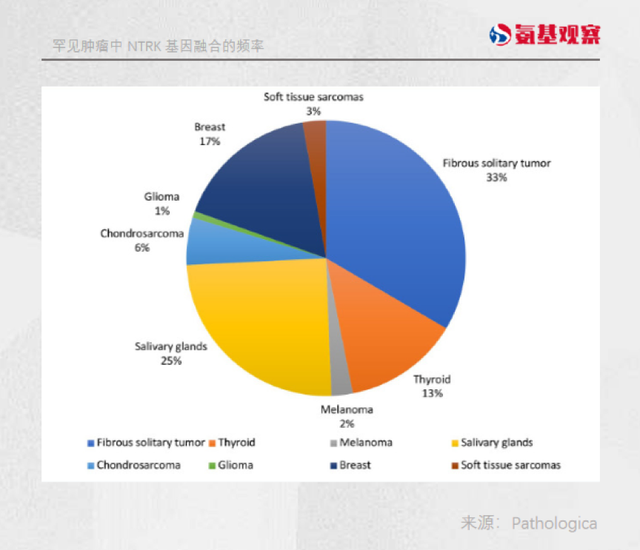
而携带NTRK基因较多的,大部分多是先天性纤维肉瘤、先天性中胚层肾瘤这些罕见肿瘤。
这也就意味着,虽然恩曲替尼看似广谱,但在多种限制条件下,实际算下来真正能用药的患者群体并不多。
这一点,从恩曲替尼以往的销售额上也能看出端倪。
2017年,罗氏以17亿美元收购Ignyta并获得恩曲替尼胶囊,分析师预计恩曲替尼的峰值销售额估计为7亿美元。
2021年,恩曲替尼全年销售额仅为4900万瑞士法郎,约合5157万美元。即便已经问世三年,恩曲替尼的销售额距离市场预期的7亿峰值仍然有不小差距。
这并非恩曲替尼多独有的情况。今年4月在国内上市的拉罗替尼,和恩曲替尼一样属于靶向TRK的泛癌种药物。早在2018年,其已经在美国上市,和恩曲替尼一样他的销售额它同样不如人意。
03 靶点式突围,未来会成为趋势吗?
正如上文所说,恩曲替尼之所以引起市场关注,主要还是在于其靶点式获批的特殊性。
靶点式获批对于药企来说,无疑具备较大吸引力。毕竟,相比于单个适应症层层划分,满世界寻找适宜入组的受试者而言,靶点式突围显然要容易许多。
对于患者来说,这同样也是好事。对于众多罕见癌症患者而言,由于患者规模较少而新药研发又无比费时费力,使得罕见癌症药物相对稀缺,众多患者面临着无药可用的困难。针对靶点获批的泛癌种药物,必然可以照顾到这一部分被忽略的患者。
并且,多个罕见病的想象空间叠加在一起后,药企仍然是有利可图的。从这个角度来说,研发泛癌种抗癌药也是一个双赢的生意。
不过,泛癌种药物的前进之路上仍然有着多重挑战。
癌症之所以难以治疗,原因之一在于它的异质性。简单来说,即便是同一个部位发生的同一种癌症,癌细胞内部的表现也会有所差异。就更不用说,不同部位肿瘤差异会有多大。
正因为如此,即便具有相同突变的不同癌种,对于靶向该突变的药物的反应也可能不同。
典型的例子就是BRAF突变。BRAF突变存在多种肿瘤中,其中大约50%的黑色素瘤和10%的结直肠癌有BRAF突变,但在用药中发现,只有黑色素瘤患者对BRAF抑制剂有显着反应。
原因在于,在结直肠癌中抑制BRAF会触发驱动癌症增殖的表皮生长因子受体 (EGFR) 信号通路,但是在黑色素瘤中这一通路并不活跃。
在其他的泛癌种抑制剂,如泛HER激酶抑制剂neratinib中,也发现了类似的情况。也是因此,抛开癌种只看突变的合理性仍然存疑。
广谱抗癌药所使用的篮子试验也遭到了质疑。不少研究人员认为,一些泛癌种药物的篮子试验使用的数据量相对较少,临床数据容易出现误差。
比如说拉罗替尼,其在三项试验中进行了临床研究,纳入了12种不同的肿瘤患者,共计176名患者。很显然,每一种肿瘤类型的数据少于通常临床研究的数据。
此外,泛癌种抗癌药还面临着耐药性问题、缺乏被FDA认可的生物标志物等问题。种种困难之下,泛癌种药物之路说起来容易,做起来难做。
总而言之,泛抗癌药物仍然存在着诸多挑战,但是科学的发展向来是螺旋上升的,药物的研发也不例外。随着更多的后来者进入市场,泛癌种药物的所面临的挑战也将会迎来更多的解决方案。