迈威生物即将登陆科创板,预计两年内有三款产品获批上市
导读:2021年12月7日,证监会发布文件批准迈威(上海)生物科技股份有限公司(以下简称“迈威生物”)在科创板首次公开发行股票注册,迈威生物的获批注册,意味着其即将成功登陆科创板。据悉,目前公司处于路演阶段,计划于12月29日询价。
2021年12月7日,证监会发布文件批准迈威(上海)生物科技股份有限公司(以下简称“迈威生物”)在科创板首次公开发行股票注册,迈威生物的获批注册,意味着其即将成功登陆科创板。据悉,目前公司处于路演阶段,计划于12月29日询价。
作为一家全产业链布局的创新型生物制药公司,迈威生物一直备受各界关注,《经济参考报》梳理迈威生物招股书发现,公司亮点颇多:
首先,在全部采用第五套上市标准的医药公司中,迈威生物的研发投入金额、研发人员数量均居前列,研发实力突出;其次,公司预计未来两年内将有三款产品获批上市,相应产品的市场前景也较为广阔;此外,公司还前瞻性地布局了产业配套体系,将加速公司产品的商业转化。
研发实力居前
迈威生物成立于2017年5月,是一家创新型生物制药企业,主营业务为治疗用生物制品的研发、生产与销售,具体为包括人用治疗性单克隆抗体、双特异性/双功能抗体及ADC药物在内的抗体药物以及包括长效或特殊修饰的细胞因子类重组蛋白药物,此次登陆科创板,迈威生物采用了第五套上市标准。
成立以来,迈威生物已建立起一条涵盖多个领域且具有竞争差异化的研发管线。招股书显示,与行业内已有产品上市或处于研发后期的生物制药公司或创新药研发公司相比,迈威生物在已申请药品上市许可产品数、临床II/III期产品数与临床I期(或IND获批)产品数方面均高于平均值和中位数。
迈威生物建设了多个特色且高效的技术平台,为管线分子的创新奠定了良好的基础。包括自动化高通量杂交瘤抗体新分子发现平台、高效B淋巴细胞筛选平台、双特异性/双功能抗体开发平台、ADC药物开发平台、PEG修饰技术平台等。每个平台都不断产出多个细分领域的优势品种。
迈威生物在研发的其他方面也颇为突出。据《经济参考报》记者统计,截至12月22日,共有29家公司采用第五套上市标准在科创板申请上市,其中28家公司所处行业为医药制造业,值得一提的是,在这28家选用第五套上市标准登陆科创板的医药公司中(下称“28家公司”),迈威生物研发投入金额、研发人员数量均居前列。
一方面,从研发投入来看,同花顺IFinD数据显示,迈威生物最近三年累计研发投入达11.13亿元,位居28家公司中第5名,且在数值上看为28家公司平均值的1.7倍;2020年,迈威生物研发投入达5.81亿元,位居28家公司中第4名,且在数值上为28家公司平均值的1.63倍。
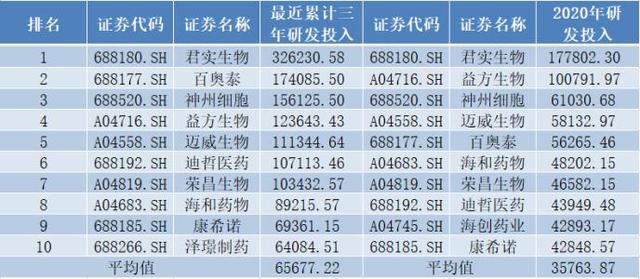
图1采用第五套上市标准的药企研发投入TOP10(单位:万元)
数据来源:同花顺IFinD、各公司招股书
另一方面,从研发人员数量上看,同花顺IFinD数据显示,截至去年底,迈威生物共有研发人员429人,位居28家公司中第4名,且在数值上看为28家公司平均值的2.37倍;与此同时,迈威生物研发人员占比为75%,位居28家公司中第9名,且从数值上看为28家公司平均值的1.38倍。
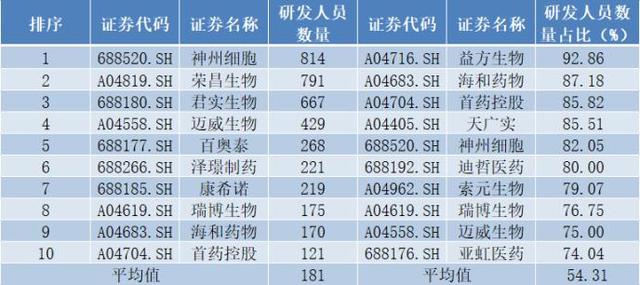
图2截至去年底采用第五套上市标准的药企研发人员数量及占比TOP10
数据来源:同花顺IFinD、各公司招股书
两年内或有三款产品获批上市
对于一家研发型药企而言,在研管线进展无疑是投资者最为关心的问题,《经济参考报》记者注意到,迈威生物管线坚持差异化布局,涵盖多个治疗领域,且公司预计两年内有三款产品获批上市,届时公司发展将迈入一个新阶段。
根据公司披露,截至目前,迈威生物拥有涵盖自身免疫、肿瘤、代谢、眼科、感染等疾病领域的15个在研品种,包括1个即将于明年1季度获得批准上市的品种;两个刚递交上市申请的品种;3个处于关键注册临床的品种;6个其他临床阶段的品种;3个临床前研究阶段的品种。
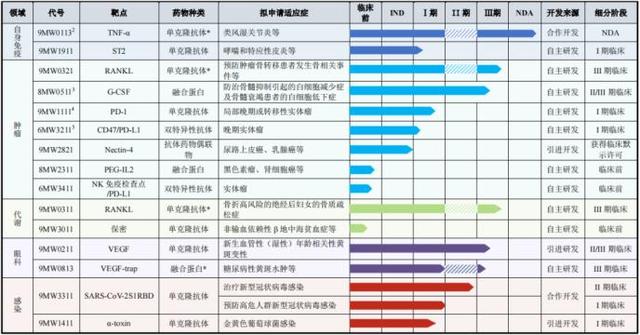
图3迈威生物研发管线进展图片来源:公司招股书
其中,9MW0113是迈威生物距离商业化最近的一款产品,预计可于2022年第一季度获得上市许可。
招股书显示,9MW0113为迈威生物与君实生物合作开发的重组人源抗TNF-α单克隆抗体注射液,属于治疗用生物制品2类,为药物修美乐 (通用名:阿达木单抗)的生物类似药,已于2019年11月7日提交产品上市申请,并在申报资料中根据提交上市申请时原研产品在中国获批3个适应症将其适应症确定为类风湿关节炎、强直性脊柱炎、银屑病。
市场空间方面,9MW0113销售前景较为广阔,根据弗若斯特沙利文分析预计,2025年阿达木单抗的市场份额将达139.62亿元,而9MW0113预计为国内第五家获批的阿达木单抗生物类似药,迈威生物预计其2025年市场占有率约为4.5%—5.5%,销售收入将达到6.28—7.68亿元。
除此之外,《经济参考报》记者注意到,迈威生物另有两款重磅产品(9MW0321、9MW0311)的上市申请刚刚获得国家药品监督管理局(NMPA)受理,值得一提的是,根据迈威生物招股书披露,两款产品预计获批上市时间均为2023年,这也意味着,迈威生物未来两年内预计将有三款产品获批上市。
其中,9MW0321为公司自主开发的重组全人源抗RANKL单克隆抗体注射液(120mg),是安加维 (通用名:地舒单抗)的生物类似药;目前国内外均尚无安加维 生物类似药获准上市,亦无其他针对RANKL的单克隆抗体获准上市,而9MW0321预计为国内第一梯队获批的地舒单抗生物类似药,先发优势较为明显。
9MW0311为迈威生物上市申请刚获受理的另一款产品,招股书显示,其为公司自主研发的重组全人源抗RANKL单克隆抗体注射液(60mg),为普罗力 (通用名:地舒单抗)的生物类似药。
目前,9MW0311竞争格局相对较好,根据招股书披露,2020年原研药物地舒单抗(商品名:普罗力 )在中国上市,中国尚未有生物类似药上市,而9MW0311预计为国内第一梯队上市的地舒单抗生物类似药。
从市场空间上看,9MW0311销售前景也较为广阔。目前我国50岁以上人群骨质疏松患病率女性超过20%、男性接近15%;2020年骨质疏松患者数量接近3亿人,至2050年将升至5亿人。
除了前述三个研发进度相对靠前的在研产品外,迈威生物还有多款“明星”在研产品处于不同的临床阶段。
譬如,9MW2821是针对明星靶点Nectin-4的ADC药物品种,可针对包括尿路上皮癌、乳腺癌、肺癌等多个实体瘤开展临床研究,据悉,这是国内企业同靶点药物中首个获准开展临床研究的品种,也是全球第二个获准开展临床研究的Nectin-4ADC品种,目前其临床试验申请已正式得到国家药监局药品审评中心的批准。
前瞻性布局产业配套体系
一家成功的药企除了需要具备强劲的研发实力与丰富的研发管线外,还离不开完善的产业配套体系。
事实上,对于诸多采用第五套上市标准的上市药企而言,由于新药研发耗资巨大,常常无法兼顾产业化能力与营销体系建设,然而,迈威生物却前瞻性地布局了相关产业配套体系,全产业链布局将加速公司产品的商业转化。
根据招股书披露,泰康生物(迈威生物全资子公司)已完成符合中、美、欧GMP标准的抗体及重组蛋白药物生产设施建设,并已通过欧盟QP审计,初步具备商业化生产能力,于2019年4月通过江苏省药品监督管理局验收并颁发药品生产许可证。
据悉,前述生产设施目前包括三条原液生产线和两条制剂生产线,其中,拥有抗体药物产能4000L(可快速扩大到8000L),拥有融合蛋白(细胞因子)产能4000L;制剂生产线可满足一次性预充针和多个规格西林瓶分装。
同时,为了进一步扩大抗体药物商业化生产能力,朗润迈威(迈威生物全资子公司)已启动大规模商业化生产基地建设项目,一期建设项目即“年产1000kg抗体产业化建设项目”,该建设项目占地6.97万平方米,建成后可实现年产1000kg抗体药物生产能力。建设规划采用一次性生物反应器及不锈钢生物反应器两种原液生产方式,建成后可形成27000L哺乳动物细胞培养规模,预计2022年投入使用。
此外,泰康生物亦已购买泰州市5.34万平方米土地用于抗体药物和重组蛋白药物车间建设,主要用于ADC药物和重组蛋白药物的商业化生产,目前已取得建设用地,开展整体规划设计工作
除积极建设生产转化体系外,迈威生物还十分注重商业拓展与营销体系建设。
根据招股书披露,迈威生物以全球市场为目标开展推广和销售,设立国际业务部和商务拓展部进行境内外市场推广及商务合作,其中9MW0113和9MW3311两个品种就境外合作和推广已签署5份正式协议及1份框架协议,合同金额累计超过1.2亿美元并可获得产品上市后的销售收益。
此外,迈威生物亦积极设立营销中心负责国内市场的推广和销售工作,目前,9MW0113上市前销售准备工作正在有序开展。
此次登陆科创板,迈威生物拟募资29.8亿元,用以投入年产1000kg抗体产业化建设项目、抗体药物研发项目与补充流动资金。
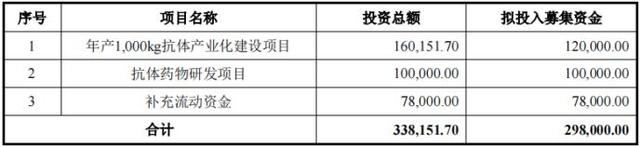
图4迈威生物募集资金用途(单位:万元)图片来源:公司招股书
而针对未来发展战略,迈威生物表示,“将利用3-5年时间将公司建设成为抗体药物生产能力一流并拥有多个独特产品的创新型生物制药公司。”