DNA为啥会自发变异?量子物理学或将揭晓谜团
导读:近期,一项研究表明,支配微小世界的量子力学可能有助于解释为什么基因突变会在DNA自我复制的过程中自发出现。
北京时间3月22日消息,近期,一项研究表明,支配微小世界的量子力学可能有助于解释为什么基因突变会在DNA自我复制的过程中自发出现。
DNA“点突变”
量子力学用于描述支配原子及其亚原子成分的奇怪规则,当描述宏观世界的经典物理规则失效时,量子就会介入进行解释,在DNA的例子中,经典物理学提供一种解释,分析了为什么DNA螺旋阶梯的某一阶突然发生变化,会导致所谓的“点突变”。据悉,DNA由脱氧核苷酸组成,而脱氧核苷酸是由碱基、脱氧核糖和磷酸构成,其中碱基有4种:腺嘌呤(A)、鸟嘌呤(G)、胸腺嘧啶(T)和胞嘧啶(C)。DNA携带着合成RNA和蛋白质所必须的遗传信息,是生物发育和正常运作必不可少的生物大分子。
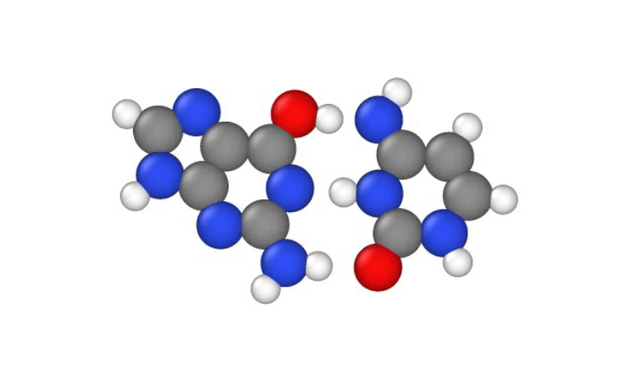
如图所示,白色的两个质子在核碱鸟嘌呤(左)和胞嘧啶(右)之间跳跃,它们在DNA链内形成碱基对。
在1月29日发表在《物理化学杂志》上的一项最新研究中,研究人员探索了另一种解释,表明一种被称为质子隧穿的量子现象可以通过允许DNA中带正电荷的质子从一个位置跳跃至另一个位置,产生点突变,反之,这将微妙地改变连接DNA双螺旋结构两侧的氢桥键,当DNA进行自我复制的时候,氢桥键会出现错误。
研究人员指出,这种微妙变化尤其可能导致DNA序列出现“错版”,当DNA链复制时,错误的DNA“字母”将配对在一起,这些字母也被称为碱基,通常以某种方式配对:A至G,G至C,但是质子隧穿会导致一些碱基混合和匹配。
英国曼彻斯特大学计算和理论化学教授萨姆·海伊说:“关于DNA碱基对中氢键和质子转移,科学家已进行了大量计算工作,这项最新研究使用了非常精湛的计算方式来重新检验该现象。”
然而,由于使用特定的计算方法,研究人员仅能在单碱基和碱基对的水平上模拟少部分DNA链,这意味着该模型不包括DNA双螺旋的两侧,也不包括位于DNA链上其他位置的碱基对,这些位置的结构可能对研究质子隧穿现象具有重大影响,但要模拟整个DNA链将需要巨大的计算能力,可能要等到计算能力或者方法进一步改进后才能解决该问题。
经典物理学与量子力学
目前,经典物理学也能提供为什么质子在DNA链周围跳跃的谜团。DNA碱基对由氢键连接在一起,氢键是一种氢原子和碱基分子之间相对较弱的吸引力,这些化学键可以通过加热被打破,因为随着温度的升高,分子会剧烈振动和抖动,导致氢原子从原来的位置弹出。
英国萨里大学勒弗休姆量子生物学博士培训中心博士生路易·斯洛康姆说:“你可以想象整个环境在抖动、振动……一切都处于动态、在移动着。”原子在绝对零度以上的任何温度下都会摆动,因为热量会增强它们的动能或者运动。
依据经典热力学,这种类型的振动有时会使氢原子跳到DNA的新位置,短暂地形成新键,但是原子很快就会弹回到原来的位置,由于DNA碱基的分子结构,氢原子倾向于在两对碱基之间形成某种“稳定”位置,它们将在这里保持很长时间,期间仅会短暂地逃至不寻常的“不稳定”位置。
氢原子仅有一个质子,一个负电荷的电子,没有中子;在其形成DNA的过程中,这些原子在形成键的时候,电子会被一对碱基“夺走”。因此2014年发表在《化学研究报告》上的一篇研究报告称,实际上,当氢原子从DNA链的一端跳至另一端时,它们会以单个质子的形式进行移动,因此科学家将该现象称为“质子转移”。
但是依据最新这项研究,经典质量转移并不能解释所有质子在DNA中跳跃的现象。从本质上讲,与我们计算量子速率的数字相比,仅通过经典热力学导致的质子在DNA中跳跃的概率非常低。换句话说,质子隧穿可能比热量自身驱动更多的质子跳跃。
跳跃障碍
质子隧穿依赖于不确定的量子质量,不适用于更大的空间,例如:在较大的空间中,你可以确定火车的位置及其行驶速度,并利用这些信息,预测火车可时到达下一站。
然而,就亚原子粒子而言,它们的确切位置和速度无法同时计算出来,科学家仅能通过计算粒子以特定速度出现在某一特殊位置的概率,来捕捉到粒子的模糊图像。在质子隧穿的背景下,科学家可以计算出质子在某个位置或者另一个位置的概率——理论上讲,质子存在于宇宙任何位置的概率都是非零的。
之前媒体曾报道称,质子隧穿意味着粒子可以穿过看似不应该通过的障碍,有时它们甚至可以跳跃障碍。
为了预测质子在DNA中何时何处可能发生转移,研究小组确定了粒子从“稳定”位置断裂至“不稳定”位置所需的能量,该阈值就是所谓的“能量位垒”,而反弹至稳定状态所需的能量就是“反向拉垒”。
研究小组称,与质子隧穿相比,由热量驱动的经典质子转移的能量位垒非常高。预测的质子隧穿率远远超过了经典质量转移,如果不考虑隧穿率,质子跳跃至另一个DNA碱基的概率将‘非常非常接近零’。
在作者计算的限制范围内,隧穿似乎在一对碱基之间的质子转移过程中起着中度至较大等级的作用。同时,研究小组还发现,A-T对之间质子隧穿的反向位垒比G-C要低很多,这意味着,如果一个质子从一对电子的A端隧穿至T端,它将立即返回,反向位垒的能量较低,从而使质子很容易会弹出其稳定。
斯洛康姆说:“然而对于G-C碱基对,它有相当大的反向位垒,这意味着该状态在相当长的一段时间内是比较稳定的,因此,一旦某个质子跳跃了G-C碱基对的位垒,它可能在一段时间内保持不稳定的位置,如果这发生在DNA复制开始之前,质子可能会在DNA链的‘错误的一侧’。”
这是因为为了复制自己,DNA首先会展开,破坏碱基对之间的键,然后,一种叫做聚合酶的物质会突然出现,将新的碱基装入开口槽中,就像拼图游戏一样。然而,问题是当聚合酶在一个不稳定位置遇到一个质子时,它可能会选择错误的“拼图碎片”作为连接的碱基,例如:一个质子可能跳跃到一个G碱基对,当聚合酶经过的时候,聚合酶附着的是T碱基对,而不是C碱基对。
该项研究具有重要意义
依据教科书《基因分析导论》,生物学家詹姆斯·沃森和物理学家弗朗西斯·克里克首次发现了DNA复制中的这种错误,他们是最早进行DNA研究的专家,这项最新研究表明,质子隧穿的作用——比热力学作用更重要,可能是导致这些突变的原因。
因此在分裂过程之前,DNA存在一个脆弱时刻,此时量子效应具有重要意义。
选择错误的“拼图碎片”作为连接的碱基从而产生的点突变可能是无关紧要的,不会改变细胞的功能或者构建蛋白质的方式,但研究人员称,它们也可能是毁灭性的,会导致镰状细胞性贫血等疾病和非小细胞肺癌等特定类型的癌症,在某些情况下,点突变也可能是十分有益的。
尽管如此,科学家仍不知道一个质子需要在不稳定位置停留多长时间才能真正发生点突变,海伊指出,最新研究仅模拟DNA链的一小部分,为了深入了解质子隧穿发生的频率,必须模拟整个系统。
目前,斯洛康姆和同事致力地对碱基对周围更大的环境进行建模,通过这种方式,他们可以理清量子物理学、经典物理学与DNA之间的关系,如何通过不同的机制驱动质子跳跃,该研究有助于揭晓什么条件下质子转移更容易发生,以及该现象触发有害基因突变的频率,这是一个至关重要的问题。(叶倾城)