研究发现关键的肠道免疫分子与肥胖、微生物组和代谢紊乱有关
导读:加拿大科学家团队领导的一项新研究表明,高脂肪饮食可以破坏已知有助于调节肠道微生物群体的肠道免疫细胞水平。
加拿大科学家团队领导的一项新研究表明,高脂肪饮食可以破坏已知有助于调节肠道微生物群体的肠道免疫细胞水平。该研究描述了这种分子的低水平如何导致有害肠道细菌的生长增加,导致炎症和胰岛素抵抗。
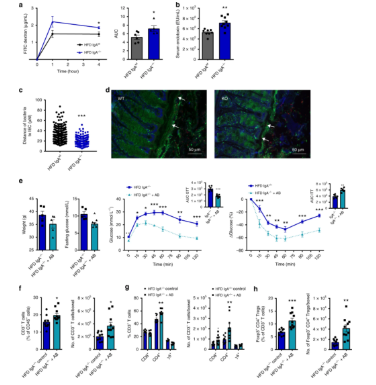
免疫球蛋白A(IgA)是由肠道中的粘膜分泌物产生的主要免疫分子。这项新的研究开始时假设IgA可能是将肠道微生物组与炎症和与2型糖尿病相关的血糖水平联系起来的关键机制。
“IgA是由我们的身体自然产生的,对于调节肠道中的细菌至关重要,”新研究的第一作者Helen Luck解释道。“它作为一种防御机制,有助于中和利用环境变化的潜在危险细菌,例如当我们具有不平衡或高脂肪饮食习惯时。”
新研究表明,使用一系列不同的小鼠模型,高脂肪饮食直接导致IgA水平下降。低IgA水平导致血糖水平恶化,以及更高的漏肠综合征倾向。
为了测试这些代谢变化是否由肠道细菌介导,研究人员将肥胖的IgA缺陷型动物的微生物组移植到没有预先存在的肠道微生物群体的小鼠中。这确实似乎确实将代谢表型转移到无菌小鼠中,表明肠道微生物组改变确实引起胰岛素抵抗和炎症。
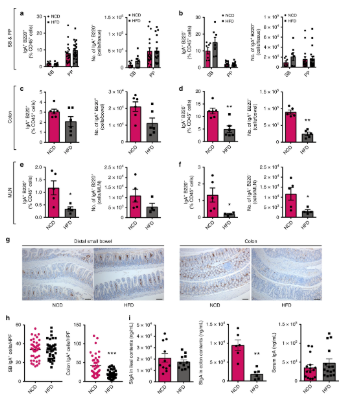
当在人类身上进行研究时,科学家发现减肥手术后肥胖患者的粪便IgA水平升高。这表明结果应该始终如一地追踪关于饮食、IgA水平和肠道免疫系统之间的这种关系。虽然先前的研究已发现人们肠道微生物组与免疫系统之间引人注目的相互作用,但这是第一项研究表明肠内稳态受IgA水平调节。这意味着对抗糖尿病和肥胖可能涉及寻找提高IgA水平的方法。
“如果我们能够增强这些IgA B细胞或它们的‘产品’,那么我们就可以控制肠道中细菌的类型。特别是那些更容易与炎症和最终胰岛素抵抗相关的细菌,”新研究作者Daniel Winer说道。
该研究的下一步是在人类受试者中更密切地研究这种机制,以更好地了解IgA缺乏与肥胖、肠道微生物群失调和代谢紊乱之间的相互关联。
这项新研究发表在《自然·通讯》杂志上。