80%小鼠肿瘤完全消失 新型CAR-T细胞"咬死"致命脑瘤
导读:来自哈佛医学院麻省总医院的科学家们展示了一项抗击大脑恶性肿瘤的研究结果。他们结合两种抗癌新技术,对胶质母细胞瘤展开有效攻击。
《自然》子刊Nature Biotechnology最新发表的一篇论文中,来自哈佛医学院麻省总医院(Massachusetts General Hospital)的科学家们展示了一项抗击大脑恶性肿瘤的研究结果。他们结合两种抗癌新技术,对胶质母细胞瘤展开有效攻击。利用可产生双特异性抗体的新型CAR-T细胞进行治疗,在80%的小鼠中,脑内的肿瘤完全消失!

胶质母细胞瘤是最常见的大脑恶性肿瘤。这种癌症侵略性极强,会迅速恶化,确诊后留给患者的时间平均只有15个月左右,5年生存率低于10%,论凶残程度,胜过被称为“癌中之王”的胰腺癌!而常规的手术、放疗和化疗,对胶质母细胞瘤的治疗效果十分有限。
免疫疗法、细胞疗法等革命性技术问世,让科学家们有了更有力的抗癌武器。例如嵌合抗原受体(CAR)T细胞,这是一种经过基因工程设计的免疫细胞,表面带有特制的抗体,能够识别癌细胞。像已获FDA批准的两款CAR-T细胞疗法(诺华的Kymriah和吉利德的Yescarta),就是针对癌细胞表面抗原CD19进行结合,用于治疗血液肿瘤。
胶质母细胞瘤的细胞表面,也有特殊的受体分子可以作为识别抗原。比如,突变形式的表皮生长因子受体EGFRvIII。这些“致癌受体”介导了异常的生长因子信号通路,驱动癌细胞不受控制地疯长。
理论上说,可以让CAR-T细胞去识别EGFRvIII,对胶质母细胞瘤发起攻击。这也正是这项研究负责人Marcela Maus教授曾经尝试过的做法。可实体瘤之所以难治,一个很棘手的原因在于“异质性”,也就说,这些癌细胞的分子特征不尽相同。在胶质母细胞瘤中,还有很多细胞不表达突变形式的EGFR,却大量表达正常的EGFR,它们同样会放大生长信号,造成肿瘤疯长。这时候,光靠识别EGFRvIII的CAR-T细胞还不能击退肿瘤。
 本研究负责人Marcela Maus教授(图片来源:丹娜-法伯癌症研究所)
本研究负责人Marcela Maus教授(图片来源:丹娜-法伯癌症研究所)
怎么能再补上一拳、提高治疗效果?这时新型免疫疗法——双特异性T细胞接合器(BiTE)上场。所谓的“双特异性”,就是可以同时靶向两个分子,它就像两个分子挂钩,一个咬住肿瘤细胞EGFR,另一个咬住效应T细胞上的表面抗原,把T细胞激活,使之产生能杀伤肿瘤的蛋白质。
但BiTE要发挥作用,还有一个问题需要解决:胶质母细胞瘤位于脑中,抗体得通过血脑屏障才能起效,这对于分子量较大的BiTE有难度。
为此,研究团队设计了一个富有创意的方法。他们把表达BiTE的基因导入CAR-T细胞,当T细胞进入大脑后,再持续产生BiTE“咬住”肿瘤细胞。
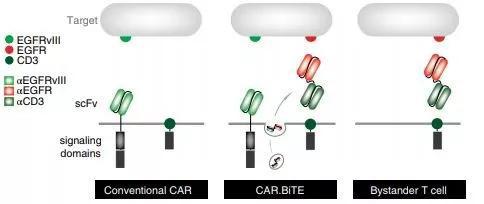 表达双特异性抗体的CAR-T细胞示意图(图片来源:参考资料[1])
表达双特异性抗体的CAR-T细胞示意图(图片来源:参考资料[1])
接下来,研究团队在胶质母细胞瘤小鼠模型中检验了这种新CAR-T细胞的治疗潜力。
他们在免疫缺陷型小鼠脑中植入了人脑胶质瘤细胞,然后把分泌BiTE的CAR-T细胞注入小鼠体内,同时靶向表达EGFRvIII和EGFR的肿瘤细胞予以打击。经过3周时间,80%的小鼠表现出了“完全缓解”,体内已经看不到肿瘤!
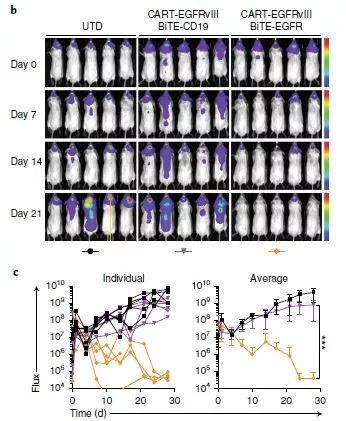 分泌BiTE靶向EGFR的CART-EGFRvIII细胞,让小鼠脑内的肿瘤在3周之内显著缩小甚至完全消失(图片来源:参考资料[1])
分泌BiTE靶向EGFR的CART-EGFRvIII细胞,让小鼠脑内的肿瘤在3周之内显著缩小甚至完全消失(图片来源:参考资料[1])
此外,由于针对EGFR的BiTE会局部地在CAR-T细胞到达的部位起作用,并不影响其他表达EGFR的正常组织,这一点研究者也在小鼠身上通过移植的人体皮肤进行了检验,为这种疗法的安全性提供了数据。
研究者为这种CART.BiTE细胞申请了专利,并希望开展进一步的临床试验。和其他癌症疗法一样,在最终确认适合用于人类之前,这种新疗法还需要更多的实验证据。“考虑到胶质母细胞瘤的存活率非常低,任何有效的疗法,哪怕只能针对一部分病例,都可以造福患者。”Maus教授相信。